
Este texto ha sido el finalista del concurso DIPC–LSC-Laboratorium en la modalidad de ensayo de divulgación científica de Ciencia Jot Down 2021. Puedes leer aquí el ensayo ganador y aquí el relato de la modalidad de narrativa.
Hace más de un siglo el médico Paul Ehrlich acuñó el término de «bala mágica» para referirse a un compuesto capaz de actuar contra un microorganismo dañino (en la jerga médica, «patógeno») sin ocasionar daños en las células de las personas a las que estaba infectando. En ese momento las «balas mágicas» vivían en el mismo universo que los unicornios alados, puesto que no existía ninguna sustancia que —ni siquiera lejanamente— cumpliera estos requisitos. Sería el propio Ehrlich el que en 1907 descubriera un compuesto antimicrobiano selectivo que, con algunas modificaciones posteriores, logró convertir en razonablemente inocuo para los pacientes a los que se administraba (teniendo en cuenta que el principal componente activo era el arsénico, obviamente tuvo que ajustar mucho la dosis para no matar al paciente a la vez que a la bacteria a la que pretendía combatir).
Desgraciadamente, su logro no tuvo continuidad y hubo que esperar veinte años a que Fleming se topara, de forma casi accidental, con la penicilina. Aunque la producción a escala industrial de la penicilina tendría que esperar casi otras dos décadas, al fin la humanidad disponía de un arma eficaz para combatir las enfermedades bacterianas que desde tiempos remotos padecía y que, en los casos más graves, llegaban a diezmarla (por poner el más dramático de los ejemplos, se calcula que cerca de la mitad de la población europea falleció a consecuencia de la epidemia de peste del siglo XIV).
Lo que es aún más importante, los trabajos de Fleming iluminaron el camino para obtener sustancias capaces de combatir al escaso centenar de especies bacterianas que causan enfermedades en el ser humano: estudiar las inmensas y pobremente conocidas comunidades microbianas de gérmenes inofensivos que, después de todo, llevan compitiendo entre sí (y con el citado puñado de «chicos malos») desde tiempos inmemoriales. No era una tarea despreciable, puesto que actualmente se estima que existen alrededor de un millón de procariotas (es decir, bacterias y arqueas) y entre dos y cuatro millones de hongos (como el famoso Penicillium del que Fleming obtuvo la penicilina).
Pese a la magnitud del reto, en las siguientes décadas los investigadores obtuvieron exitosamente un buen número de antibióticos que comenzaron a conformar un nutrido arsenal para combatir las infecciones bacterianas (nótese que actualmente la expresión «bala mágica» ha caído completamente en desuso, pero que aún tiene gran aceptación la utilización de terminología bélica o armamentística).
Algunos de estos nuevos antibióticos mostraban una estructura química muy similar a la de la penicilina, con un característico anillo denominado «anillo betalactámico», con lo que comenzaron a conocerse como «antibióticos betalactámicos». Otros presentaban estructuras moleculares muy distintas y se fueron agrupando en otras «familias» con nombres tan exóticos como aminoglicósidos, tetraciclinas o macrólidos.
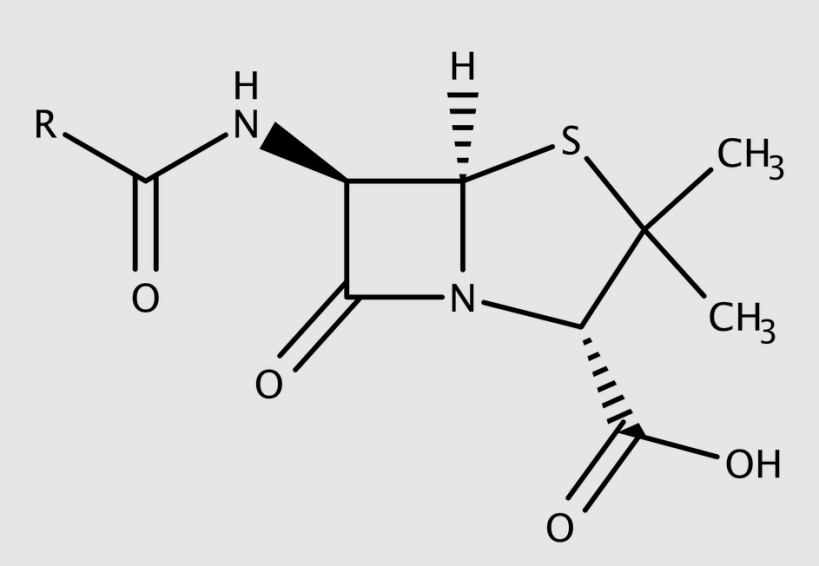
A la postre, la irrupción de los antibióticos en la lucha contra las enfermedades causadas por bacterias resultó tan determinante que puede compararse —siguiendo con las analogías bélicas— con el desarrollo de los misiles de crucero o «misiles inteligentes» (pues la simple irrupción de las armas de fuego no tuvo en la historia humana un impacto tan rápido). Como además cada familia o grupo de antibióticos ataca diferentes «dianas», cuando una bacteria resultaba resistente a un antibiótico se disponía de alternativas para combatirla. Porque, efectivamente, incluso en los albores de la «era antibiótica» existían bacterias resistentes (las balas eran mágicas, pero no milagrosas). De hecho, la bacteria con la que Fleming estaba trabajando cuando realizó su descubrimiento era resistente a la penicilina (y andaba tan enfrascado en sus dificultades para purificarla, que su primer pensamiento fue emplear la penicilina para librarse de las bacterias contaminantes, sin plantearse que se le brindaba una herramienta para tratar las enfermedades infecciosas).
Los motivos por los que las bacterias sobrevivían (y sobreviven) a los antibióticos son variados: algunas especies son intrínsecamente resistentes a ciertos compuestos porque carecen de las moléculas «diana». Retomando el símil militar, un antibiótico que actúa como misil antitanque no sirve de nada si la bacteria no utiliza carros de combate (hasta este punto son selectivos los antibióticos: una sustancia «antitanque» no es efectiva contra infantería ni contra una fuerza aérea).
En otros casos, las bacterias no son «estructuralmente» resistentes, pero han desarrollado en su proceso evolutivo, por acción de la selección natural, mecanismos de resistencia ante algunos antibióticos. No conviene olvidar que los antibióticos los «inventaron» los propios microorganismos, posiblemente para hacerse la zancadilla entre ellos, así que es normal que hayan desarrollado «antídotos» o —volviendo a la jerga militar— «contramedidas». Lo que resulta harto improbable es que una especie concreta haya desarrollado sistemas para volverse invulnerable a todos los antibióticos existentes. Por tanto, los hallazgos de marcadores de resistencia antibiótica en bacterias procedentes de lugares prácticamente intocados por el ser humano (como el suelo de una zona perdida de Alaska) o de épocas donde nos consta que no existían tratamientos antibióticos (como el Imperio inca) no han de causarnos ninguna extrañeza, aunque en su momento llevó a algunos científicos a rascarse la cabeza con cierta perplejidad.
Partiendo de este escenario, el uso generalizado de antibióticos a partir de la década de 1940 ejerció una presión selectiva muy intensa sobre las especies bacterianas: allá donde se aplicaba un antibiótico, las variantes («cepas», en la jerga de los microbiólogos) sensibles fueron desapareciendo, y el hueco que dejaron lo ocuparon las supervivientes, es decir, las cepas resistentes.
En conclusión, se produjo un incremento exponencial de las cepas resistentes, reduciendo por tanto la utilidad del antibiótico concreto (que con cada uso tendría una eficacia cada vez más limitada, en lo que viene a ser un caso paradigmático de «morir de éxito»).
En el caso de los antibióticos betalactámicos (es decir, penicilinas y sustancias afines) uno de los mecanismos de resistencia más relevantes deriva de la existencia de unos genes que permiten a las bacterias sintetizar unos compuestos capaces de «desactivarlos». A estas sustancias que «derriban» los «misiles» betalactámicos antes de que alcancen su objetivo se las denomina penicilasas (en el caso de que solo actúen contra las penicilinas) y, de forma genérica, betalactamasas (en uno de esos trabalenguas que los especialistas no son capaces de apreciar). Las betalactamasas constituyen un motivo de honda preocupación, puesto que los betalactámicos aún constituyen un pilar esencial en los protocolos terapéuticos actualmente en uso.
Para empeorar la situación, las bacterias —sobre todo las del grupo denominado gramnegativos— no se preocupan demasiado por la propiedad intelectual y reparten los genes que codifican para estas betalactamasas con prodigalidad, contribuyendo a que la resistencia se expanda de forma incontenible, pues más y más bacterias (que a veces ni siquiera están emparentadas) reciben el folleto «Construya su propio misil antibetalactámicos paso a paso».
Inicialmente nuestra especie reaccionó a las contramedidas bacterianas con simple y llana fuerza bruta: incrementando las dosis de antibióticos para desbordar las barreras que oponían las bacterias resistentes.
Esta estrategia obviamente era viable solo en cierta medida, puesto que —más pronto que tarde— resulta físicamente imposible incrementar la dosis o bien resulta toxicológicamente inaceptable, porque los antibióticos causan más daño por «fuego amigo» que el infringido a las bacterias que constituyen el verdadero objetivo (en grandes cantidades, los misiles dejan de ser «inteligentes» y se vuelven menos selectivos). Por supuesto existía la opción de realizar un ataque con otro grupo de antibióticos por lo que, de forma paralela, se intensificó la búsqueda de nuevos compuestos capaces de eludir las defensas microbianas (a veces por simple modificación química de antibióticos naturales ya conocidos).
Pese a todos los esfuerzos, rápidamente se hizo evidente que el minúsculo enemigo era un adversario formidable. En cuanto una cepa lograba optimizar sus defensas, los genes correspondientes se distribuían entre sus congéneres e incluso entre cepas de especies no relacionadas con la misma efectividad y rapidez con la que un vídeo se vuelve viral en las redes sociales. Había que buscar alternativas, explorar otras posibilidades e identificar nuevas tácticas antes de regresar a una era preantibiótica, donde la gente fallecía por algo tan trivial como una apendicitis o una faringitis (las publicaciones científicas a veces se refieren a este escenario con la evocadora e inquietante expresión «apocalipsis antibiótico»).
En la década de 1950 comenzó a explorarse una nueva estrategia que abría un amplio abanico de posibilidades: ¿sería posible administrar junto con el verdadero antibiótico un «señuelo» que atrajera la atención de la contraofensiva bacteriana? En 1954 se confirmó esta hipótesis al comprobarse que la cefalosporina N (un compuesto lejanamente «emparentado» con las penicilinas) atraía buena parte de la atención de las betalactamasas y protegía, en cierta medida, del «fuego de artillería» microbiano a otros betalactámicos que eran sensibles a las betalactamasas (concretamente, su «prima» la benzilpenicilina y su «hermana» la cefalosporina C). En definitiva, se había demostrado que una combinación de antibióticos betalactámicos mostraba una actividad antibacteriana superior a la suma de sus efectos cuando se administran de forma independiente, lo que se conoce como efecto sinérgico.
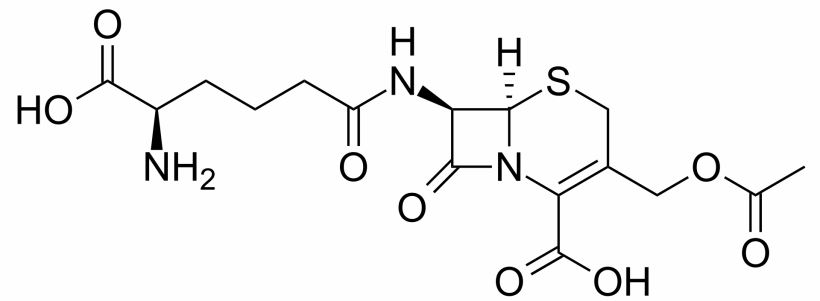
Sin embargo, aunque las sustancias como la cefalosporina C eran capaces de crear una distracción, no inutilizaban las «plataformas de lanzamiento» bacterianas. Hacía falta elevar las prestaciones de estos «señuelos» a un nivel superior, lo que se logró con el descubrimiento de un humilde betalactámico con una actividad antibacteriana residual (que es el término empleado en los artículos científicos para calificar, de forma elegante y políticamente correcta, a las sustancias que son poco más que inútiles): el ácido clavulánico.
El ácido clavulánico llevó la sinergia a otro nivel, puesto que no se limita a atraer la atención de las betalactamasas (evitando que, al menos momentáneamente, puedan destruir los betalactámicos de corte «ofensivo»), sino que se une a estas betalactamasas y las inutiliza. A costa de su propia destrucción, todo hay que decirlo. Podría decirse que actúa como un dron que se lanza en un ataque suicida sobre las «baterías de tierra» bacterianas y las borra del mapa, dejando a los microorganismos sin respuesta ante los misiles que llevan la verdadera «carga explosiva» (no olvidemos que el ácido clavulánico aisladamente apenas tiene capacidad para amenazar seriamente la integridad de la bacteria).
Los bioquímicos llaman a los compuestos del primer tipo (como la cefalosporina C) inhibidores competitivos, puesto que «compiten» por la atención de las betalactamasas, atrayendo en parte el «fuego» sobre sí mismos. Los que actúan como el ácido clavulánico reciben el nombre de inhibidores suicidas, dado que se autodestruyen al inutilizar a su objetivo. También podríamos denominarlos inhibidores kamikazes, como los pilotos japoneses de la segunda guerra mundial.
El ácido clavulánico no es, ni mucho menos, el único kamikaze del arsenal farmacológico, pero sí uno de los más empleados. La próxima vez que le prescriban antibióticos, eche un vistazo a la composición, porque quizás figure en ella el ácido clavulánico (a veces con el nombre de clavulanato). En ese caso, contemple con cierto respeto a ese humilde comprimido: está a punto de ingerir una combinación sinérgica de sustancias con la que va a bombardear a su adversario bacteriano con misiles inteligentes acompañados de unos eficaces drones suicidas. Bienvenido a una guerra que ni individualmente ni como especie podemos permitirnos perder…












Estupendo artículo, me ha encantado. Muchas gracias!
Llevamos mucho tiempo oyendo hablar de la resistencia de las bacterias a las a antibióticos, pero con este símil bélico cualquiera puede entender los procesos detrás de esa resistencia y las medidas que utilizan los científicos para evitarla. Muy buen artículo.