
Todos creemos conocer la historia. Alexander Fleming tenía un cultivo de microorganismos cuando un descuido, una ventana mal cerrada, hizo que una de las placas de cultivo se contaminara. El asombrado médico vio que alrededor de aquellas pequeñas colonias del hongo verde del pan, el Penicillium, no crecían las bacterias y de esa casualidad tan sencilla ¡zas! surgió uno de los medicamentos más útiles del siglo XX: la penicilina. ¡Mentira! Además, Lord Randolph Churchill había pagado la educación a un muchacho que luego salvó la vida de su hijo Winston, el primer ministro británico, y aquel joven médico era Fleming. ¡También mentira! La ciencia no es así, nunca es así, por lo que vamos a ver si contamos algo más y la historia es un poco más real y mucho más interesante.
Alexander era hijo de un granjero, Hugh Fleming, que se casó en segundas nupcias a los cincuenta y nueve años y ya sesentón tuvo cuatro hijos más, el tercero de los cuales era nuestro protagonista. El vetusto padre murió cuando Alexander tenía siete años y el muchacho, tras terminar la secundaria, estuvo cuatro años trabajando en una compañía naviera. El que realmente pagó su educación fue su tío John, que murió, y el muchacho de veinte años decidió dedicar el dinero de la herencia a estudiar medicina. En la facultad, Alexander formaba parte del club de tiro con rifle y el capitán del equipo, que quería seguir contando con él al terminar los estudios porque era buen tirador, le ayudó a conseguir un puesto en el departamento de investigación del hospital de St. Mary para que pudiera seguir viviendo en Londres y compitiendo con el equipo. Tras trabajar unos años allí, consiguió una plaza de profesor y de ese puesto marchó a los hospitales de campaña en el frente de Francia durante la I Guerra Mundial. Durante la guerra vio con horror la cantidad de jóvenes que morían de gangrena gaseosa y descubrió que los antisépticos mataban más gente que las infecciones que supuestamente trataban. Las autoridades militares no quisieron saber nada de novedades y siguieron con los protocolos habituales.
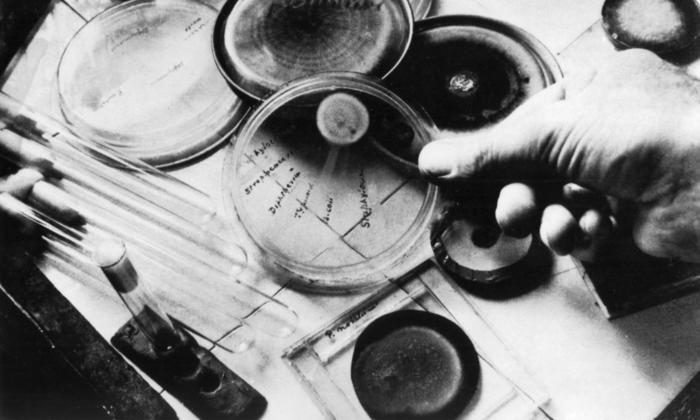
Tras terminar la guerra, Fleming volvió al St. Mary e hizo su primer gran descubrimiento: la lisozima. Trabajaba con placas Petri, pequeños platos tapados por otro plato donde se extiende una capa de un medio de cultivo y allí crecen las bacterias relativamente protegidas. Una de esas leyendas, quizá verídica en este caso, dice que Fleming estornudó encima de una de esas placas abiertas y vio que muchas bacterias morían. La lisozima es una enzima presente en muchas secreciones, incluyendo la saliva, las lágrimas, la leche y el moco, que destruye las paredes de muchos microorganismos. Sería el primero de sus errores afortunados.
La leyenda dice que el 3 de septiembre de 1928 Fleming volvió a trabajar después de las vacaciones de verano, pero en realidad seguía de vacaciones —antes las universidades tenían vacaciones «de verdad»— y volvió a Londres para asistir a un colega cirujano que se había infectado con un bacilo hemolítico en una autopsia. Fleming tenía buena fama como investigador, acababa de ser nombrado catedrático de Bacteriología y era un buen observador, pero el laboratorio estaba a menudo desordenado y sucio y sus cuadernos de laboratorio tenían grandes huecos y observaciones descuidadas. Antes de irse de vacaciones había colocado sus cultivos de estafilococos en un esquina del laboratorio, pero algunos se habían estropeado y los desechó.
Al parecer Fleming había tirado ya las placas estropeadas, pero un colega, Merlin Pryce, se acercó a cotillear un rato, y mientras charlaban Fleming iba mirando las placas descartadas. Los dos vieron algo llamativo: alrededor del hongo las bacterias habían desaparecido. De nuevo la leyenda comenta que Fleming dijo «es gracioso» y se lo enseñó a su ayudante, quien le recordó que aquello se parecía a cuando había descubierto la lisozima. Sin embargo, parece que el hongo solo detendría el antibiótico si se hubiera sembrado antes o al mismo tiempo que la bacteria y que requiere unos días de temperatura fría, algo que sucedió solo unos pocos días en ese verano londinense de 1928. Fleming fue mucho más afortunado de lo que nunca pensó. Aquella placa —o una parecida— terminó sus días en el British Museum, donde actualmente puede ser contemplada por turistas y nativos.
No mucho tiempo después Fleming determinó que el hongo producía una sustancia a la que llamó primero «jugo del moho», luego «el inhibidor» y finalmente «penicilina», que detenía el crecimiento de muchas bacterias, incluido el estafilococo. Otro golpe de suerte fue que después de probar cientos de cepas de Penicillum se vio que la original de Fleming era una de las tres mejores, una cepa excepcional. Lo de las ventanas tampoco es cierto, porque estaban muy altas y no se podían abrir. Una fuente más fiable puede ser un laboratorio micológico que había en el piso de abajo y que una espora hubiese entrado por la puerta del laboratorio de Fleming, que estaba siempre abierta. ¿Por qué mintió Fleming diciendo que el hongo habría entrado por la ventana? Quizá porque el comité Nobel había empezado sus deliberaciones en Estocolmo y no era buena idea dar la imagen de que el posible premiado o su instituto no eran capaces de mantener las esporas bajo control.
Fleming no tenía idea de química, pero empezó a trabajar con dos ayudantes con más experiencia que él. Aun así fueron incapaces de estabilizar la penicilina, con lo que ni podían probarla en animales, ni conseguían extraerla para tenerla en cantidades suficientes, ni lograban purificarla para que fuera segura de usar en pacientes. Además, los médicos no le dejaban acercarse a ellos. El artículo original de Fleming contiene errores, omite información importante y tuvieron que pasar doce años hasta que la penicilina se pudo usar como medicamento. Diez años después del descubrimiento inicial un grupo de la Universidad de Oxford empezó a trabajar en la penicilina y consiguió resolver uno a uno estos problemas. Se trataba de Howard Florey, un agresivo patólogo australiano con seis ayudantes entre los que estaba Ernst Chain, un bioquímico judeoalemán que había huido tras las llegada de los nazis al poder, llegando a Inglaterra con diez libras en el bolsillo, todo un capital.
El grupo de Oxford empezó con una financiación de veinticinco libras (no veinticinco mil, veinticinco), pero afortunadamente la Fundación Rockefeller les dio cinco mil dólares para un año. Florey esperaba haber recibido financiación para tres años, la duración normal de un proyecto de investigación, pero la fundación veía que Gran Bretaña se hundía en la guerra, no estaba claro si los laboratorios biomédicos tendrían mucho futuro en esas circunstancias y aquello parecía investigación básica, la competencia entre un hongo y una bacteria, algo sin mayor interés. El propio Chain lo reconoció años más tarde: «La posibilidad de que la penicilina tuviera un uso práctico en la medicina clínica no entraba en nuestras cabezas cuando empezamos el trabajo». Algo que deberían pensar los que oponen la investigación básica a la investigación aplicada.
Cuando se le preguntó a Fleming por qué no había sido él quien demostrase las propiedades terapéuticas del antibiótico, echó la culpa a los médicos clínicos que no le daban fácil acceso a los pacientes, a los químicos que no habían mostrado interés por aquel producto fúngico e incluso a sus propios ayudantes por no haber profundizado en su descubrimiento. Sus pruebas sugerían que la penicilina era rápidamente inactivada por la sangre, por lo que no parecía ser muy interesante para cualquier infección que necesitase su transporte por vía intravenosa como la meningitis, la neumonía o la peritonitis, y quizá tan solo valía para problemas de la piel donde se pudiera aplicar tópicamente. Después de su descubrimiento, Fleming apenas volvió a trabajar con la penicilina.
Mientras tanto, la II Guerra Mundial había comenzado y el país sufría los primeros desastres como la evacuación de Dunquerque y la batalla de Inglaterra. El potencial de la penicilina para tratar a los heridos se fue haciendo cada vez más claro. El punto de inflexión tiene fecha: el 25 de mayo de 1940. Ese día las pruebas en ratones —hubo que sacrificar miles de ratones para que la penicilina fuese segura y eficaz— demostraron que una nueva era había comenzado: infectaron a cincuenta ratones con estreptococos y a la mitad les dieron penicilina. A los pocos días, los veinticinco a los que se dio el antibiótico estaban sanos mientras que los veinticinco sin él estaban muertos. Florey declaró: «Hemos topado con una de esos medicamentos muy raros que no solo matan las bacterias en un tubo de ensayo sino también en un animal vivo sin causarle daño. Nos dimos cuenta de que la penicilina podría jugar un papel vital en la guerra».
Dándose cuenta de la importancia del descubrimiento y preocupados por el curso del conflicto que Gran Bretaña parecía ir perdiendo, Florey, Chain y dos colegas frotaron esporas de Penicillium en el forro de sus trajes y sus abrigos para que si Inglaterra era invadida los cuatro científicos intentaran escapar con el hongo, y así poder continuar su investigación lejos de las garras de los nazis. El nuevo fármaco tenía importancia estratégica porque los alemanes eran los inventores y líderes en la fabricación de sulfamidas, el primer medicamento contra los microorganismos realmente eficaz, y los aliados no tenían nada parecido.
El equipo de investigación británico trabajó en la producción de penicilina con una enorme escasez de medios. Para cultivar los hongos probaron cajas metálicas de galletas, latas de gasolina, botellas, y finalmente el envase que demostró ser más eficaz: las cuñas de metal esmaltado que usaban los hospitales para que los pacientes hicieran sus necesidades. El instrumental del laboratorio se montó con bañeras, estanterías, bidones, papeleras, compresores de frigoríficos y centrífugas haciendo que Chain, siempre un poco particular, comentara «un poco menos de improvisación y un poco más de profesionalidad habría beneficiado nuestro trabajo». No fue fácil. La penicilina se extraía en amilacetato y después se volvía a extraer en agua usando un sistema en contracorriente. Las impurezas se quitaban con una técnica nueva, la cromatografía en columna, y se concentraba usando un destilador en vacío y otra técnica novedosa, la crioliofilización, que después se usaría para hacer café descafeinado. Seis «chicas de la penicilina» fueron contratadas para mantener la producción en un sótano húmedo, frío y con olor a moho por un sueldo más bajo del que habrían ganado de camareras o trabajando en una fábrica. Ese antro fue el único centro de producción de penicilina hasta el año 1943. Florey había contactado con los laboratorios británicos Wellcome —la principal farmacéutica del país— en 1940, pero la guerra hacía que estuvieran produciendo vacunas, antitoxinas y plasma sanguíneo, los productos que parecían más urgentes en el campo de batalla, así que le contestaron que no tenían el menor interés en dedicarse a cultivar un hongo que parecía ser «tan temperamental como una cantante de ópera».

Florey y los demás siguieron fabricando penicilina mientras los aviones alemanes bombardeaban aquella zona del East London donde tenían el laboratorio. No recibieron ningún impacto directo, pero algunos de los que trabajaban allí vieron desde la azotea cómo ardía su casa mientras ellos seguían purificando el antibiótico. Henry Dale, uno de los grandes científicos ingleses, le dijo a Florey que patentar la penicilina sería poco ético y no se hizo. Florey y Heatley marcharon a Estados Unidos en los famosos barcos negros —convoyes que navegaban sin luces para intentar esquivar a los submarinos alemanes— a intentar convencer a sus colegas americanos de que produjeran penicilina, pero las empresas yanquis no quisieron ponerse a ello por miedo a que la síntesis química de la molécula sustituyera a la producción microbiológica del hongo e hiciera perder la inversión.
Finalmente, el bombardeo de Pearl Harbor y la entrada en la guerra de los Estados Unidos hizo que todo se acelerase y el Gobierno americano puso en marcha un programa de investigación sobre la penicilina e instaló un centro piloto en una fábrica de Peoria (Illinois) que se había dedicado a fabricar whisky antes de la Ley Seca y tenía experiencia por tanto en técnicas de fermentación. Los americanos desarrollaron una técnica que multiplicaba por veinte la producción pero no funcionaba bien con la cepa de Fleming; había que buscar otra que creciera más rápido. Ordenaron la búsqueda de mohos de Penicillium por todo el mundo y el ejército se encargó de transportarlos a Peoria para probarlos. A la fábrica llegaron paquetes con el moho metido en botellas, cajas de cartón y sobres desde lugares como Ciudad del Cabo, Chongjin y Bombay, pero irónicamente la mejor cepa fue una que encontraron en la propia Peoria, enviada por un ama de casa a la que le había salido en un melón un moho «precioso y dorado» y que quería contribuir al esfuerzo bélico.
Para tranquilizar a las empresas farmacéuticas y convencerlas de que se metieran en el negocio de la penicilina, el Gobierno americano les ofreció una desgravación por un lado y puso, por otro, un nuevo impuesto sobre los beneficios que les animó a invertir en investigación y desarrollo. Las grandes farmacéuticas como Merck, Squibb, Abbot y Winthrop decidieron que era mejor darse ese dinero a sí mismas que al tío Sam y se pusieron a colaborar, aportando cada una aquellos conocimientos en los que eran líderes. También había emprendedores que montaban pequeñas fábricas de penicilina en sótanos, usando viejas botellas de licor para cultivar los hongos y consiguiendo trucos y mejoras con su imaginación y voluntad de asumir riesgos. Pfizer, que era una empresa más joven y quería meter la cabeza, y cuyo presidente había perdido una hija por culpa de una infección, desarrolló el método de fermentación en grandes incubadores que producía grandes cantidades de penicilina de gran pureza, y fue el que triunfó.
En septiembre de 1940 un policía de Oxford, Albert Alexander, de cuarenta y ocho años, fue la primera persona tratada con penicilina. Alexander se había hecho un rasguño en la cara con un rosal trabajando en su jardín. La herida se infectó con estreptococos y estafilococos, y la infección se extendió a los ojos y al cuero cabelludo. Le llevaron al hospital de Radcliffe y le trataron con lo único que había, sulfamidas, pero la infección empeoró y tuvo abscesos purulentos en los ojos, los pulmones y el hombro. Florey y Chain oyeron del caso en una cena y pidieron a los médicos de Radcliffe que probaran su penicilina «purificada».
Tras cinco días de inyecciones Alexander empezó a mostrar mejoría, pero se acabó la penicilina —toda la que existía en el mundo— y murió. El 14 de marzo de 1942 se trató con penicilina al primer paciente en Estados Unidos. Era una mujer llamada Anne Miller; su embarazo se había malogrado y había desarrollado una septicemia hemolítica causada por estreptococos que la llevaba a la muerte, y en esa primera prueba se gastó la mitad de la producción conseguida hasta ese momento en Estados Unidos. Tres meses más tarde ya se había conseguido penicilina para tratar a diez pacientes. Un problema es que la penicilina se eliminaba rápidamente por vía renal, así que se decidió recolectar la orina de los pacientes, volver a purificar el antibiótico que había allí y reutilizarlo. A los pacientes, claro, esto no se lo contaban.
En Gran Bretaña, mientras tanto, el Gobierno apostó por el antibiótico y nombró un Comité General de la Penicilina al que proporcionó varias fábricas de quesos, de gomas y de piensos dispersas por el país para que fabricaran allí la penicilina y corrieran menos riesgo de ser destruidas en un ataque aéreo alemán. Aun así había problemas y, por ejemplo, la lactosa esencial para hacer crecer el hongo había que disputársela a las fábricas de fórmulas lácteas para biberones. Todo escaseaba en un país cercado por los submarinos y los aviones alemanes.
Las primeras pruebas a gran escala de la penicilina se hicieron en el frente norteafricano, en las tropas que luchaban contra los tanques de Rommel, y los resultados fueron espectaculares: soldados heridos en las piernas y que habrían quedado mutilados para siempre un año antes volvían a andar. En la Primera Guerra Mundial el 18 % de las muertes de soldados fue por infecciones por neumonías, en la Segunda bajó al 1 %. Los médicos veían asombrados que incluso las heridas más grandes sanaban sin infectarse. La fama le llegó al hongo con el desembarco de Normandía, al escribir la periodista Lee Miller un artículo para la revista Vogue sobre los tres salvavidas —sulfamidas, penicilina y sangre— que multiplicaban el efecto salutífero de las manos hábiles de los cirujanos.

Es curioso que los alemanes no desarrollaran la penicilina. Fleming había mandado muestras del hongo a colegas germanos antes de la llegada de Hitler al poder y había mucho publicado sobre el nuevo fármaco que Alemania podía conseguir fácilmente en países neutrales como Suiza. La respuesta puede ser que las sulfamidas eran muy alemanas y se ganaba mucho dinero con ellas, así que las grandes químicas del Reich no querían matar la gallina de los huevos de oro por un pájaro aún volando. Aun así, la farmacéutica suiza CIBA le pidió a Florey un cultivo de Penicillium y los británicos pensaron que los alemanes iban detrás del antibiótico. Los japoneses se pusieron a trabajar en la penicilina en 1944 tras llevarse copias de artículos científicos sobre la penicilina a bordo de un submarino. Probaron setecientas cincuenta cepas, pero solo unas pocas producían algo de penicilina, por lo que temían que fuera una estrategia de propaganda de los Aliados para distraer recursos materiales y humanos. Finalmente el Gobierno nipón puso dos fábricas —una de productos lácteos y otra de seda— a producir penicilina, pero cuando estaban ya preparados para producirla masivamente las bombas de Hiroshima y Nagasaki pusieron fin a la guerra.
Durante la guerra y la inmediata posguerra la penicilina era un bien escaso. Al igual que con otros productos médicos como las vendas, el cloroformo y la morfina, se dio prioridad a los soldados pues ellos ponían su vida en peligro por el bien común. El asedio a Stalingrado hizo que estos productos prácticamente se agotaran en Europa y los nazis hicieron propaganda de las hierbas medicinales para intentar distraer a la población de la carencia de remedios verdaderamente eficaces. Todavía alguno se lo sigue creyendo. La penicilina se convirtió en la zona aliada en un producto escaso, prohibido para los civiles salvo en casos de ensayos clínicos y sujeto en algunos casos al mercado negro. Con la paz llegaron productos como pasta de dientes con penicilina o lápiz de labios con penicilina para que los besos fueran «higiénicos», prometiendo la posibilidad de «besar a quien quieras, cuando quieras y como quieras, evitando todas las consecuencias salvo el matrimonio».
Las fuerzas de ocupación aliadas en Alemania y Japón se plantearon no «gastar» penicilina en atender las necesidades de la población civil de los países derrotados, a los que querían castigar. Un motivo sencillo les hizo cambiar de opinión: las mujeres que se entregaban a la llamada «prostitución del hambre», prostituirse a cambio de algo de comida, estaban contagiando a los soldados de las potencias vencedoras un alto número de enfermedades venéreas. Así que se decidió que la penicilina, cuya producción ya era masiva y económica, se convirtiese en un auténtico medicamento benefactor de toda la humanidad.
¿Y la historia de que Fleming salvó a Winston Churchill con la penicilina? Es cierto que Churchill tuvo una infección peligrosa en 1943, pero no había apenas penicilina entonces y era un tratamiento experimental. La realidad es que, al parecer, le trataron con sulfamidas pero no quisieron que se supiera que le había salvado un «medicamento alemán».
Para leer más:
- Brown K (2008) «Fighting fit. Health, Medicine and war in the Twentieth Century». The History Press, Stroud.
- Grossmann CM (2008) «The First Use of Penicillin in the United States». Ann Intern Med 149: 135-136.
- Hare R (1982) «New light on the history of penicillin». Med History 26: 1-24.
- Markel H (2013) «The real story behind penicillin». PBS Newshour. Enlace.












Interesante, ameno y bien escrito.
Gracias, Josele. Una alegría que te haya gustado.
Quizá me equivoco, pero creo que el famoso «That’s funny», que se traduce en el articulo como «es gracioso», suena antinatural así.
Humildemente propongo traducirlo mejor como «Qué curioso»
Gracias por la sugerencia. Creo que tienes razón y es una traducción mejor que la mía. Un abrazo
Pingback: Corre corre, que no te pillo!
Pingback: La verdadera historia de como Fleming casi no descubre la penicilina | obiKuo
Pingback: La verdadera historia de como Fleming casi no descubre la penicilina | Blog de Alcocer Sotil
Pingback: La verdadera historia de la penicilina
Pingback: ¿Está rota la máquina de hacer ciencia? |
Pingback: cómo la suerte cambió al mundo
Pingback: El descubrimiento de la penicilina: cómo la suerte cambió al mundo | iOS Móvil
Pingback: El descubrimiento de la penicilina: cómo la suerte cambió al mundo – Jorge Ulises Latino
Me pareció un excelente artículo y muy completo.
Pingback: El descubrimiento de la penicilina < Objetivo Digital
Salvo la parte de que fueron las bombas de Hiroshima y Nagasaki las que le pusieron fin a la guerra… excelente artículo!
https://foreignpolicy.com/2013/05/30/the-bomb-didnt-beat-japan-stalin-did/
Magnífico artículo.
Jot Down es una gran revista.
Pingback: Cómo se produjo penicilina en plena Guerra Mundial - Diario Sanitario
Pingback: Cómo se produjo penicilina de forma masiva en plena Guerra Mundial - La Fragua
Pingback: How penicillin was massively produced during World War | Spain's News
Buenísimo el artículo!
Pingback: Penicilina y Covid-19: la historia se repite
Pingback: Penicilina y Covid-19: la historia se repite – El Vocero Hispano
Pingback: Penicilina y covid-19: la historia se repite - Player 8
Pingback: Penicilina y covid-19: la historia se repite – Cambio Político
Pingback: Penicilina y covid-19: la historia se repite - Periodico liberal
Pingback: La universidad y el laboratorio repiten la historia | Revista Gallo
Me gustaría saber más sobre la llamada «prostitución del hambre» ¿Cómo fue el proceso para brindarle a dichas mujeres el medicamento?
Pingback: Medicamentos de origen natural - Parte 1 Supervivencia y Desastres Supervivencia y Desastres
Pingback: Serendipia = suerte x sagacidad - Jot Down Cultural Magazine
«parece que el hongo solo detendría el antibiótico si se hubiera sembrado antes o al mismo tiempo que la bacteria»
¿Detendría, o contendría?
Saludos.
Pingback: Penicilina y covid-19: la historia se repite - LQS